F2_Aula 01 – TM_Fundamentos
A Termologia (termo = calor + logia = estudo) é a parte da Física que estuda a Energia Térmica (Calor) e seus fenômenos.
Todo Corpo em Movimento, em relação a um dado referencial, possui uma energia relacionada a esse movimento denominada de Energia Cinética.
“Quando um corpo é aquecido, ou resfriado, há uma variação na energia cinética de suas moléculas.”
Portanto, dizer que um corpo está mais “quente” ou mais “frio”, fisicamente é dizer que as moléculas da matéria que compõem este corpo estão mais agitadas ou menos agitadas.

A figura abaixo mostra esquematicamente a variação da energia cinética das moléculas após receberem calor.
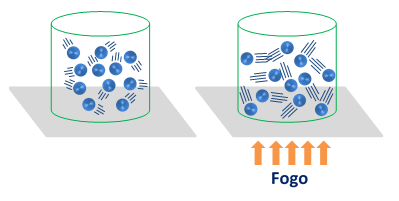 A base da termologia está no estudo do comportamento dessas moléculas.
A base da termologia está no estudo do comportamento dessas moléculas.
É claro que nem sempre temos condições de estudar esse comportamento, pois, estamos falando de moléculas o que exige um laboratório com equipamentos apropriados para tanto, por exemplo, o uso de um microscópio.
Porém, baseado no comportamento das moléculas e seus efeitos, conseguimos correlacionar um comportamento macroscópico que podemos “enxergar” com nossos próprios olhos, sem a utilização de um laboratório.
Portanto, podemos dividir o estudo da termologia em microscópico e macroscópico.
“Microscopicamente são estudados os fenômenos relacionados à energia cinética de átomos e moléculas, suas velocidades, suas interações, etc”.
“Macroscopicamente são estudados os fenômenos relacionados à temperatura, volume, pressão, estado, etc”.
Em nosso dia-a-dia sabemos que a matéria se apresenta de três maneiras (estados) diferentes, por exemplo, uma barra de ferro (estado sólido), a água contida num copo (estado líquido) e o gás contido em um balão numa festa de aniversário (estado gasoso).
Obs.: existem ainda dois estados que não ouvimos falar muito.
Apenas para registro: após o estado gasoso vem o plasma, que é encontrado nas estrelas, por exemplo, e o estado anterior ao sólido que vou denominar de estado zero.
Quando observamos microscopicamente o estado líquido, sólido ou gasoso, vemos que as moléculas que compõem a matéria estão em constante agitação.
Se há agitação, há movimento, e como citado acima, há a presença de energia cinética.
“A Energia Cinética das moléculas em agitação é denominada de Energia Térmica.”
Portanto, quando esfriamos ou aquecemos um determinado corpo, estamos diminuindo ou aumentando a energia cinética de suas moléculas.
Para identificar essa troca de energia térmica entre corpos, definimos uma grandeza física que é bem conhecida de todos: Calor.
“Calor é a Energia Térmica em Transito que flui, naturalmente, de um corpo mais quente para outro mais frio.”
Nota: fisicamente quando uma pessoa diz que “está com calor”, ainda vai, mas dizer que o dia está “calor” fica sem sentido. O ideal é dizer que o dia está “quente”.
A primeira unidade de medida do calor, estabelecida antes de se entender o calor como troca de energia, foi a Caloria (cal).
Estudos realizados no século XIX estabeleceram a ideia de calor como forma de energia, sendo James Prescott Joule um dos cientistas a realizar estudos nessa área e, em sua homenagem, no Sistema Internacional, a medida da energia recebeu o seu nome: joule ( J ).
O próprio Joule através de experimentos chegou a uma relação entre as duas unidades de energia:
Você já deve ter pensado em “perder calorias” para ficar um pouco mais em forma.
“Como estamos vendo, perder calorias significa perder energia. Portanto, estamos nos referindo a fazer um esforço físico para queimarmos as gordurinhas em excesso e aí sim, associarmos a quantidade de gordura queimada com a energia equivalente.”
Quando estamos falando sobre energia, nos referimos ao estudo microscópico da termologia.
A grandeza física macroscópica relacionada ao calor é a Temperatura.
“Temperatura é a grandeza física que mede o grau de agitação das moléculas ou átomos de um corpo.”
Conclusões:
- Quando aquecemos um corpo, microscopicamente fornecemos energia térmica ao mesmo, ocasionando um aumento da agitação de suas moléculas, tendo como consequência macroscópica um aumento de sua temperatura.
- Quando resfriamos um corpo, microscopicamente retiramos energia térmica do mesmo, ocasionando uma diminuição da agitação de suas moléculas, tendo como consequência macroscópica uma diminuição de sua temperatura.
Obs.: observamos que temperatura é a grandeza macroscópica que utilizamos para medir a agitação térmica das moléculas ou átomos, que é uma grandeza microscópica.
Mudando um pouco de assunto, você gosta de café com leite?
O que acontece quando misturamos em uma caneca café fervendo com leite frio? Obtemos um café com leite morno?
Microscopicamente as moléculas do café estão “bastante” agitadas, ou seja, com velocidades altas, enquanto que as do leite estão “pouco” agitadas, ou seja, com velocidades baixas.
Desprezando o efeito do meio e considerando apenas o sistema café com leite, o choque entre as moléculas das duas substâncias produz uma troca de energia entre suas moléculas.
Devido aos choques, as moléculas do café, mais agitadas, perde energia cinética, enquanto que as moléculas do leita, menos agitadas, ganha energia cinética, havendo depois de certo tempo, equilíbrio entre a mistura, ou seja, todas as moléculas vibram com a mesma intensidade, ou seja:
“Microscopicamente após ser atingido o equilíbrio térmico, macroscopicamente a mistura fica com a mesma temperatura.”
Conclusão:
“Num sistema isolado, corpos em Equilíbrio Térmico estão a uma mesma Temperatura.”
Ou seja, o equilíbrio térmico é o estado em que as temperaturas de dois ou mais corpos de um sistema isolado são iguais, cessando os fluxos de troca de calor entre eles.
Seguindo nosso exemplo, se pusermos dentro de uma garrafa térmica leite frio e café quente, depois de certo tempo será atingido o equilíbrio térmico, estando tanto o leite quanto o café a uma mesma temperatura.
Utilizando a lógica para dois corpos, podemos concluir que a temperatura de equilíbrio terá um valor entre os valores das duas temperaturas iniciais de cada componente da mistura.
Exercícios Resolvidos
01 – (FisMática) Quando aquecemos um corpo, podemos dizer que:
-
- a energia potencial de suas moléculas aumenta;
- a velocidade de suas moléculas diminui;
- a velocidade de suas moléculas aumenta;
- há uma mudança em seu estado físico;
- nenhuma das anteriores.
Resolução:
Vimos na teoria que quando aquecemos um corpo, fornecemos energia na fora de calor para o mesmo e como consequência há um aumento na energia interna do mesmo ocasionando um aumento na velocidade de suas moléculas.
Portanto a alternativa correta é a letra c.
02 – (FisMática) Uma determinada marca de pão de forma traz em sua embalagem a informação de que cada fatia fornece 57 kcal de energia quando consumida. Determine a energia equivalente no SI (Sistema Internacional).
Resolução:
Vimos na teoria que a relação entre caloria e o joule (unidade no SI) é dada por: 1 cal = 4,1868 J.
Portanto temos que: 57 kcal = 57×4,1868 = 238,6 kJ
03 – (PUC Campinas) Sobre o conceito de calor, pode-se afirmar que se trata de uma:
-
- medida da temperatura do sistema;
- forma de energia em transito;
- substância fluida;
- quantidade relacionada com o atrito;
- energia que os corpos possuem.
Resolução:
Como vimos na teoria a alternativa correta é a letra b.
Exercícios Propostos
01 – (FEI-SP) Um sistema isolado termicamente do meio possui três corpos, um de ferro, um de alumínio e outro de cobre. Após um certo tempo, verifica-se que as temperaturas do ferro e do alumínio aumentaram. Podemos concluir que:
a) o corpo de cobre também aumentou a sua temperatura;
b) o corpo de cobre ganhou calor do corpo de alumínio e cedeu calor para o corpo de ferro;
c) o corpo de cobre cedeu calor para o corpo de alumínio e recebeu calor do corpo de ferro;
d) o corpo de cobre permaneceu com a mesma temperatura;
e) o corpo de cobre diminuiu a sua temperatura.
02 – (FATEC-SP) Três corpos encostados entre si estão em equilíbrio térmico. Nessa situação:
a) os três corpos apresentam-se no mesmo estado físico;
b) a temperatura dos três corpos é a mesma;
c) o calor contido em cada um deles é o mesmo;
d) o corpo de maior massa tem mais calor que os outros dois;
e) há mais de uma proposição correta.
03 – (UNIFESP) O SI (Sistema Internacional de unidades) adota como unidade de calor o joule, pois calor é energia. No entanto, só tem sentido falar em calor como energia em trânsito, ou seja, energia que se transfere de um corpo a outro em decorrência da diferença de temperatura entre eles. Assinale a afirmação em que o conceito de calor está empregado corretamente.
a) A temperatura de um corpo diminui quando ele perde parte do calor que nele estava armazenado.
b) A temperatura de um corpo aumenta quando ele acumula calor.
c) A temperatura de um corpo diminui quando ele cede calor para o meio ambiente.
d) O aumento da temperatura de um corpo é um indicador de que esse corpo armazenou calor.
e) Um corpo só pode atingir o zero absoluto se for esvaziado de todo o calor nele contido.
04 – (UNISA-SP) O fato de o calor passar de um corpo para outro deve se:
a) à quantidade de calor existente em cada um;
b) à diferença de temperatura dentre eles;
c) à energia cinética total de suas moléculas;
d) ao número de calorias existentes em cada um;
e) nada do que se afirmou acima é verdadeiro.
05 – (UFRGS) Para que dois corpos possam trocar calor é necessário que:
I – estejam a diferentes temperaturas.
II – tenham massas diferentes.
III – exista um meio condutor de calor entre eles.
Dessas afirmações, é (são) correta(s)?
a) apenas a I b) apenas a II c) apenas a I e a II d) apenas a I e a III e) todas
06 – (UFV-MG) Quando dois corpos de materiais diferentes estão em equilíbrio térmico, isolados do meio ambiente, pode-se afirmar que:
a) o mais quente é o que possui menor massa;
b) apesar do contato, suas temperaturas não variam;
c) o mais quente fornece calor ao mais frio;
d) o mais frio fornece calor ao mais quente;
e) suas temperaturas dependem de suas densidades.
07 – (CEFET-SP) Calor é:
a) energia em trânsito de um corpo para outro, quando entre eles há diferença de temperatura
b) medido em graus Celsius
c) uma forma de energia que não existe nos corpos frios
d) uma forma de energia que se atribui aos corpos quentes
e) o mesmo que temperatura
08 – (UFP-RS) Considere as afirmações a seguir:
I. Quando dois corpos estão em equilíbrio térmico, ambos possuem a mesma quantidade de calor.
II. Quando dois corpos estão em equilíbrio térmico, ambos possuem a mesma temperatura.
III. Calor é transferência de temperatura de um corpo para outro.
VI. Calor é uma forma de energia em trânsito
Das afirmações acima, pode-se dizer que:
a) I, II, III e IV são corretas
b) I, II, III são corretas
c) I, II e IV são corretas
d) II e IV são corretas
e) II e III são corretas
09 – (FATEC-SP) Um sistema A está em equilíbrio térmico com outro B e este não está em equilíbrio térmico um outro C. Então, podemos dizer que:
a) os sistemas A e C possuem a mesma quantidade de calor.
b) a temperatura de A é diferente da de B.
c) os sistemas A e B possuem a mesma temperatura.
d) a temperatura de B é diferente da de C, mas C pode ter temperatura igual à do sistema A.
e) nenhuma das anteriores.
Gabarito
Ex. 01 – alternativa e.
Ex. 02 – alternativa b.
Ex. 03 – alternativa c.
Ex. 04 – alternativa b.
Ex. 05 – alternativa a.
Ex. 06 – alternativa b.
Ex. 07 – alternativa a.
Ex. 08 – alternativa d.
Ex. 09 – alternativa c.
